La spectroscopie en astronomieLe rayonnement élecromagnétiqueDes rayonnements différents selon leur longeur d'onde et l'énergie transportée :
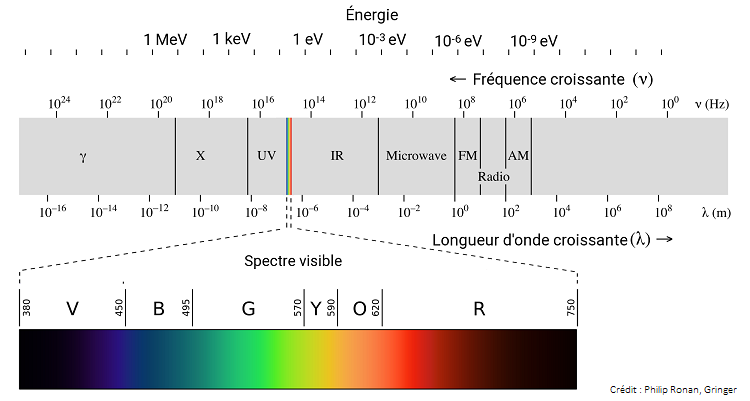 Le visibleLe visible est la partie du rayonnement électromagnétique que nous voyons. C’est une toute petite fenêtre dans les rayonnements
électromagnétiques, dont les longueurs d’onde vont de 0,4 à 0,8 µm. Nos yeux sont cependant capables de discerner dans ce faible intervalle toutes
les couleurs que nous connaissons. SpectreOn appelle spectre une analyse de la lumière en ses composantes colorées. Pour l’obtenir, il faut disperser les couleurs, ce qui se fait en faisant passer le faisceau lumineux dans un prisme de verre. 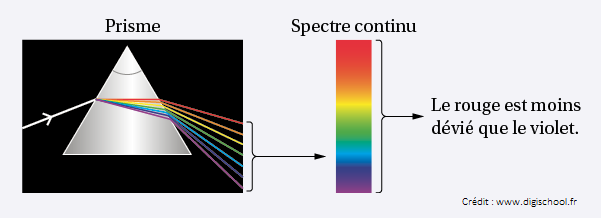 Les rayonnements électromagnétiques sont des ondesUne onde est caractérisée par :
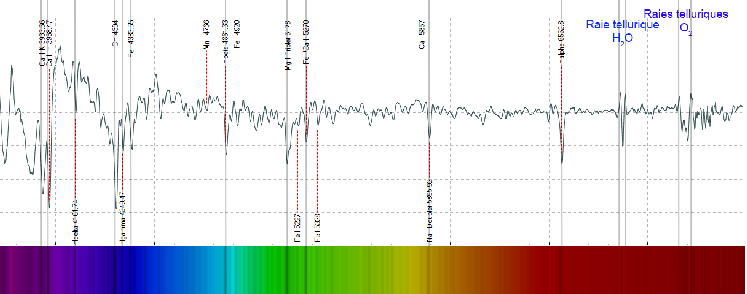
Lorsque la longueur d’onde double, le nombre d’oscillations par seconde diminue de moitié. Ces deux grandeurs sont donc liées. Pour les ondes électromagnétiques, on a relation très simple entre la longueur d’onde et la fréquence : λ ν = c où c est la vitesse de la lumière. 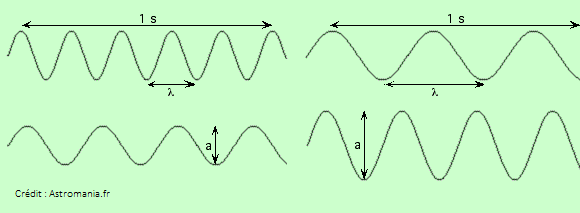 Si la lumière traverse un gaz, ce dernier va interagir avec la lumière et laisser une trace.  On voit ici l’interaction entre la lumière et différents gaz : l’hydrogène, l'hélium, l'oxygène, le carbone, et l’azote. On voit
des lignes verticales. Chaque élément a une empreinte spectrale particulière. C’est un peu comme un code barre. Cela est très intéressant car cela
permet de déterminer, à distance la composition chimique des astres à des milliards d’années-lumière de nous. Raie d'absorptionL'atome, avec ses électrons en mouvement sur des orbites quantifiées, n'est qu'un modèle utile pour visualiser la solution
de problèmes et facile à exprimer par le langage. Il s'agit d'un modèle purement conventionnel. 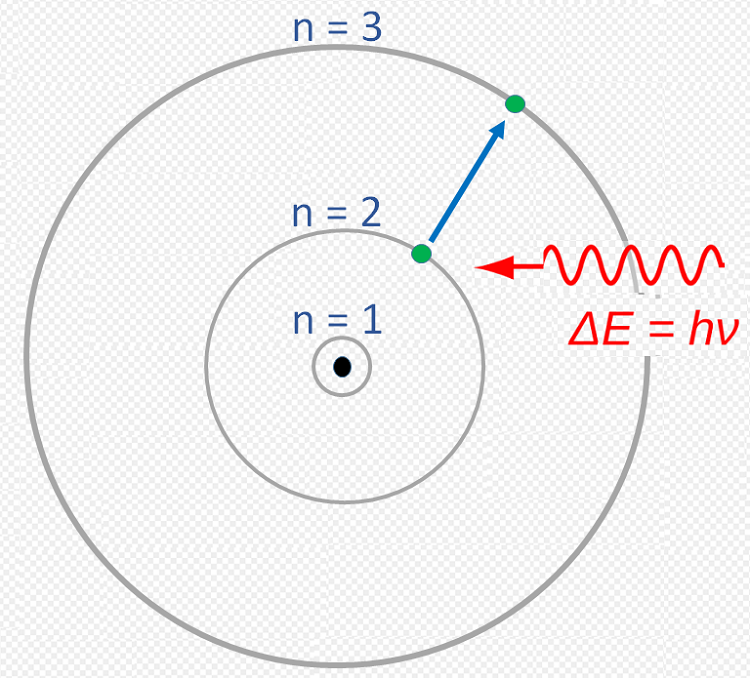 Raie d'émissionPuisque les orbites basses sont de moindre énergie que les orbites hautes, elles sont plus stables. L’électron aura donc toujours tendance à retomber vers une orbite basse, en diminuant son énergie. Pour assurer la conservation de l’énergie, il émet un photon dont la couleur est exactement celle qui correspond à la différence d’énergie entre les deux orbites. C’est l’origine des raies d’émission. 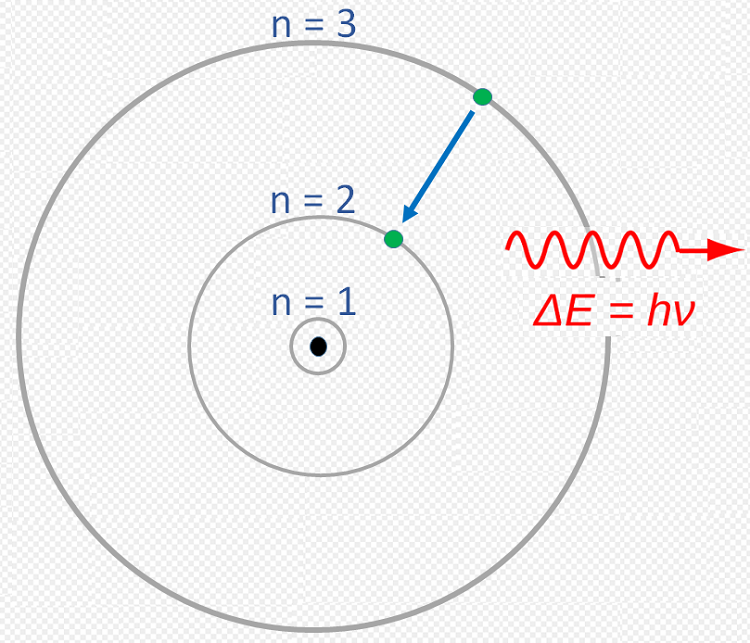 Puisque les raies d’émission et d’absorption correspondent à des transitions dans les deux sens entre les mêmes niveaux d’énergie, elles ont
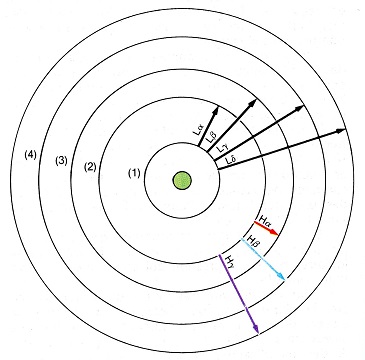
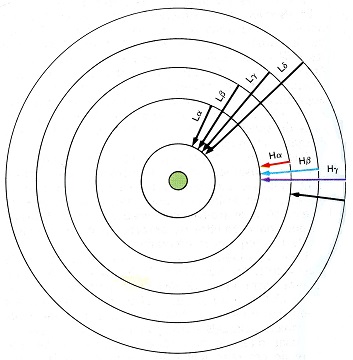
nécessairement la même couleur. On peut dire aussi que la même raie pourra se manifester en émission ou en absorption selon les circonstances. Séries de Lyman et de BalmerSi l'on considère l'atome d'hydrogène, les transitions de l'unique électron se produisent entre le niveau le plus bas,
indiqué par le chiffre "1" sur la figure de gauche et les niveaux supérieurs donnent naissance à des rayonnements ultraviolets, auxquels
correspondent dans le spectre les raies dites de la "série de Lyman".
Dans le cas d'atomes plus complexes que l'hydrogène, et donc possédant plusieurs électrons gravitant autour du noyau, c'est l'électron le plus externe qui absorbe ou ément de l'énergie en passant du'un niveau à un autre. On dit que l'atome est au niveau fondamental lorsque cet électron est sur le plus bas niveau possible, on le dit "excité" lorsqu'il se trouve à un niveau supérieur. L'utilité de la spectroscopieL’astronome dispose, grâce à la spectroscopie, de LA solution pour sonder les planètes et les étoiles à distance.
La lumière (dans toutes les longueurs d’ondes) est le moyen le plus important de connaissance des astres (on a quelques informations provenant de
la physique des particules (neutrinos), et on en obtient maintenant des ondes gravitationnelles ; tout le reste provient de la lumière,
et plus généralement des ondes électromagnétiques).
 Accueil - Liens utiles - Contact . |